Farmacopea Ufficiale Italiana: aggiornamento tabelle 3, 4, 5 e 7 – DM 18 giugno 2020 – G.U. n.174 del 13/07/2020
A cura di Ettore Brunello Florio
Col DM 18 giugno 2020 pubblicato in G.U. n.174 del 13-07-2020 si aggiornano le tabelle 3, 4, 5 e 7 della Farmacopea Ufficiale Italiana XII edizione.
Quest’ultimo Decreto va a modificare altri 2 precedenti DM di aggiornamento della Farmacopea:
- DM 17 maggio 2018 (GU Serie Generale n.129 del 06-06-2018 – Suppl. Ordinario n. 27 – clicca per il link) – aggiornamento F.U. di tutte le tabelle tranne che per la 3.
2. DM 24 luglio 2018 (GU Serie Generale n.188 del 14-08-2018 – clicca per il link) – aggiornamento F.U. della tabella 3.
Cercheremo di evidenziare le principali novità riportate in quest’ultimo Decreto di aggiornamento, in particolar modo per ciò che può riguardare l’attività galenica.
Tabella 3 (sostanze da tenere in armadio chiuso a chiave)
DM 18 luglio 2020 – aggiornamento del DM 24 luglio 2018.
Rispetto al precedente aggiornamento, sono stati aggiunti alla lista altri 3 farmaci (Efedrina, Pseudoefedrina e Scopolamina). A questa lista però, in armonia con il Regolamento CLP (Classification Labelling Products- EC 1272/2008 – clicca per il link), vanno anche aggiunte tutte le materie prime classificate come H300, H310, H330 (GHS06 cat. 1 e 2). Tutte queste sono quindi da considerarsi con obbligo di chiusura chiave e dispensabili solo con i relativi formalismi previsti dalla legge per i veleni (ricetta non ripetibile con dose in tutte lettere, obbligo del pittogramma GHS06 – teschio e tibie – in etichetta e/o scritta “VELENO”, dispensazione a persona con età eguale o superiore ai 16 anni, obbligo di registrare sulla ricetta il nome e cognome dell’acquirente, applicazione in tariffazione dei relativi supplementi). Fanno eccezione le seguenti formulazioni officinali che non sono da considerarsi veleno: “Iodio soluzione cutanea”, “Iodio soluzione orale”, “Iodio Unguento” e Iodio ed Acido Salicilico Soluzione Cutanea”.
Nota: il regolamento europeo CLP nasce armonizzandosi al sistema internazionale GHS (Globally Harmonized System of Classification and Labelling of Chemicals – clicca per il link). I criteri di classificazione del CLP sono divenuti vigenti a livello europeo dal 1° giugno 2015 e vanno a sostituire i criteri di classificazione delle precedenti normative.
Ricordiamo che nel Regolamento CLP:
H300 = Letale se ingerito.
H310 = Letale per contatto per contatto con la pelle
H330 = Letale se inalato
Tutte queste materie prime riportano il teschio in etichetta.
Per completezza d’informazione riportiamo una tabella CLP in riferimento al sistema GHS.
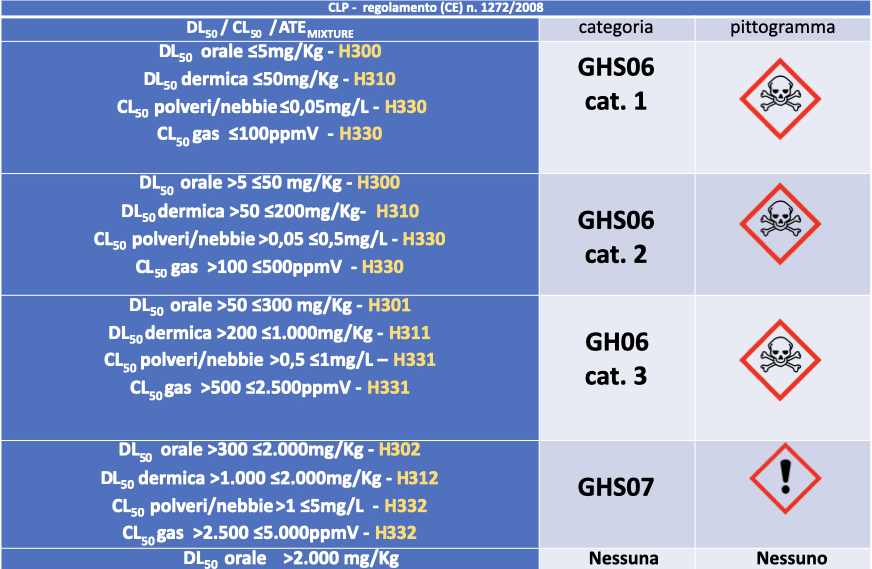
Dalla tabella si evince che devono essere considerate con obbligo di chiusura a chiave, non solo le materie prime presenti in Tabella 3, ma anche tutte quelle che riportano il teschio in etichetta ma solo se accompagnato da una o più delle sigle H300, H310 e H330 (GHS06 cat.1 e 2 definite nella CLP come letali). Le altre (GHS06 cat.3), pur riportando il teschio in etichetta, non vanno considerate letali ai fini dei formalismi e degli obblighi. Resta il fatto che, se il farmacista lo ritiene opportuno può, per motivi di sicurezza, tenere sotto chiave anche altre materie prime (es. corrosivi come acidi forti, basi forti, etc.) meglio però se in armadi dedicati. e specifici per lo stoccaggio. Solitamente le sostanze pericolose, anche se non classificate GHS06 cat.1 e 2, riportano in etichetta l’obbligo della conservazione sotto chiave (consiglio di prudenza P405: “conservare sotto chiave”).
COMMENTO: questa precisazione, riportata in quest’ultimo aggiornamento, pone fine all’annosa questione relativa all’errore di stampa ( “o” al posto di “e”) presente nel precedente aggiornamento che praticamente incorporava nella categoria letali/veleni, con tutte le conseguenze che ne derivavano, anche la GHS06 cat. 3 (H301, H311 e H331). Ora è chiaro che la sola presenza in etichetta del teschio non è sufficiente per la classificazione di letale/veleno se non accompagnata da una o più delle sigle H prima elencate (H300, H310 e H330). Quindi, nel caso in etichetta al teschio si accompagnino una o più sigle H301, H311 e H331, la materia prima non è da considerarsi letale. (NDR: questa è probabilmente la più interessante novità/chiarimento di questo aggiornamento)
Ricordiamo che diverse sostanze molto pericolose come gli acidi Nitrico, Solforico, Fluoridrico, Tricloroacetico, Fenico ma anche altri principi attivi come la Pilocarpina, la Tubocurarina cloruro, etc. non sono più presenti in Tabella 3 già dallo scorso aggiornamento del 2018.
NOTA: dobbiamo chiarirci sugli aggettivi che accompagnano le sostanze. Può sorgere confusione fra i termini VELENO, TOSSICO, ESTREMAMENTE TOSSICO, LETALE e NOCIVO. Questa confusione sorge per il passaggio dalla vecchia normativa (DSP-UE) alla nuova (Regolamento CLP ) ma anche per i termini presenti nel TULS art.146 e 147, nel R.D. 30-09-1938 n. 1706 e nelle NBP della Farmacopea Ufficiale Italiana XII Ed e nel DM delle NBP-semplificate. Con buona approssimazione possiamo affermare che VELENO è un sinonimo di LETALE (GHS06 cat.1 e 2), che ESTREMAMENTE TOSSICO è sinonimo di LETALE GHS06 cat.1, TOSSICO è sinonimo di LETALE GHS06 cat.2. Le materie prime classificate GHS06 cat.1 e 2 (H300, H310 e H330) sono considerate letali (precedentemente classificate come “tossiche” e “estremamente tossiche”) e vanno lavorate sotto cappa per tossici indossando i DPI previsti nelle relative schede di sicurezza e sanitizzando a fine preparazione l’ambiente confinato di lavoro . Per tali ragioni possono essere manipolate solo nei laboratori di farmacia che seguono le NBP- FU. Sono esclusi da tali lavorazioni i laboratori che seguono le NBP semplificate (DM 22 giugno 2005 – G.U. n.210 del 09-09-2005 “NBP Semplificate”).

Riportiamo una tabella che mette a confronto la vecchia lista prevista dal DM 24 luglio 2018 con la lista presente nell’attuale aggiornamento
Tabella 4 (elenco dei prodotti che il farmacista non può vendere se non in seguito a presentazione di ricetta medica)
DM 18 luglio 2020 – aggiornamento del DM 27 maggio 2018.
Per quanto riguarda la galenica troviamo le seguenti frasi di interesse:
Al punto 13) “Ormoni sintetici ed estrattivi, medicinali ad azione ormonica, ad eccezione della melatonina in quantità inferiore a 2mg per dose.”
COMMENTO: si può quindi preparare e dispensare anche senza prescrizione medica la melatonina in dosaggi inferiori a 2mg. Tale frase era già presente nel precedente aggiornamento.
Al punto 32) Farmaci veterinari: “Non è ammessa la prescrizione di medicinali contenenti sostanze stupefacenti tramite REV.”
Note) “Ad eccezione di quanto riportato in tabella, sono altresì esentati dalla vendita dietro presentazione di ricetta medica I PREPARATI OFFICINALI allestiti in farmacia che contengano una quantita’ per dose e per confezione di principio attivo uguale o inferiore a quella del medicinale industriale esentato in sede di A.I.C. ad eccezione di quelli che sono soggetti alla legge 14 dicembre 2000, n. 376, e successive modificazioni”.
COMMENTO: il Ministero precisa per dose e per confezione ovvero l’officinale è esentato dall’obbligo di prescrizione medica non solo se prodotto in dose ma anche in quantità di farmaco per confezione eguale o inferiore al medicinale registrato (AIC). Tale importante deroga era già presente nel precedente aggiornamento.
Note) “I PREPARATI MAGISTRALI a base di principi attivi che non siano riconducibili ad una categoria terapeutica presente in tabella, ma per i quali esista un equivalente medicinale industriale autorizzato…(omissis)… devono essere dispensati alle medesime condizioni previste per lo stesso medicinale autorizzato.
COMMENTO: tale importante deroga era già presente nel precedente aggiornamento.
Tabella 5 (Elenco dei prodotti la cui vendita è subordinata a presentazione di ricetta medica da rinnovare volta per volta e da ritirare dal farmacista).
DM 18 luglio 2020 – aggiornamento del DM 27 maggio 2018.
Nell’ultimo aggiornamento 2020 non vi sono particolari novità rispetto all’aggiornamento 2018, tranne che per l’eliminazione e l’aggiunta di alcune voci e per il punto 18):
| ELIMINATI | INTRODOTTI |
| Cisapride | Acitretina |
| Etretinato | Ketorolac |
| Floctafenina | |
| Oxifenbutazone | |
| Veralipride |
18) Farmaci veterinari: “Non è ammessa la prescrizione di medicinali contenenti sostanze stupefacenti tramite REV.”
COMMENTO: viene riportata anche nella tabella 5 la stessa prescrizione presente nella tabella 4 (NDR: ovviamente).
Tabella 7 (Elenco delle sostanze e preparazioni ad azione stupefacente o psicotropa)
DM 18 luglio 2020 – aggiornamento del DM 27 maggio 2018.
Riportiamo le modifiche della sottotabella IV che è stata aggiornata in considerazione dei vari DM che si sono succeduti negli ultimi anni:
| NON PIU’ PRESENTI | INTRODOTTI |
| Delorazepam | 4-Clorodiazepam |
| Fonazepam | |
| Metilmorfonato | |
| Tionordazepam | |
| Ro 07-4065 |
Tabella Medicinali Sezione A – Medicinali e Sostanze Attive ad Uso Farmaceutico – Medicinali soggetti a prescrizione medica speciale: ricetta ministeriale a ricalco. E’ stata aggiunta la Tiletamina. Per quanto riguarda i farmaci di questo elenco contrassegnati con (**) e inclusi nell’allegato III-bis che usufruiscono delle modalità prescrittive semplificate nella terapia del dolore: non vi è stato alcun cambiamento.
Tabella Medicinali Sezione B – Medicinali e Sostanze Attive ad Uso Farmaceutico – Medicinali soggetti a prescrizione medica da rinnovarsi volta per volta: ricetta ripetibile: non vi è stato alcun cambiamento.
Tabella Medicinali Sezione C – Medicinali e Sostanze Attive ad Uso Farmaceutico – Medicinali soggetti a prescrizione medica da rinnovarsi volta per volta: ricetta non ripetibile: non vi è stato alcun cambiamento restano sempre Barbexaclone, Fenobarbital e Pentazocina.
Tabella Medicinali Sezione D – Medicinali e Sostanze Attive ad Uso Farmaceutico – Medicinali soggetti a prescrizione medica da rinnovarsi volta per volta: ricetta non ripetibile: sono stati aggiunti Lormetazepam e Midazolam
Tabella Medicinali Sezione E – Medicinali e Sostanze Attive ad Uso Farmaceutico – Medicinali soggetti a prescrizione medica: ricetta ripetibile: non vi è stato alcun cambiamento.
Allegato III-bis – Medicinali che usufruiscono delle modalità prescrittive e semplificate: è stata introdotta la seguente frase: Medicinali a base di cannabis per il trattamento sintomatico di supporto ai trattamenti standard.

